Профессор с мировым именем Сидельникова Вера Михайловна выделяла три формы гиперандрогении при беременности. Рекомендовала лечение дексаметазоном. Диагностику и дозировку препарата проводить по определению уровня 17-КС. Мне особенно приятно отметить, что профессор отмечала значение определения стероидного профиля в моче беременных .
|
|
Работы профессора Веры Михайловны Сидельниковой позволили обрести радость материнства бесчисленному количеству людей. К сожалению, после ее трагической гибели усилились ни чем не обоснованные и абсолютно беспочвенный грубые нападки на ее научный подход. Вера Михайловна Сидельникова являлась настоящим ученным. Все ее научные выводы и рекомендации хорошо аргументированы. В.М. СидельниковаПРИВЫЧНАЯ ПОТЕРЯ БЕРЕМЕННОСТИСидельникова В.М. «Привычная потеря беременности» — М.: Триада-Х, 2005. - 304 с. ISBN 5-8249-0077-9 В руководстве освещены современные представления, основанные на опыте работы сотрудников НЦАГиП по важнейшей проблеме практического акушерства — невынашиванию беременности. Дано описание тактики подготовки к беременности и ведения беременности у пациенток с этой патологией. Освещены вопросы этиологии и патогенеза невынашивания беременности, методы диагностики и лечения, а также причины привычной потери беременности. Отдельные разделы посвящены вопросам профилактики и лечения инфекций у пациенток с данной патологией, а также тромбофилическим осложнениям, антифосфолипидному синдрому, преждевременным родам. Книга рассчитана на врачей женских консультаций, акушеров-гинекологов. ISBN 5-8249-0077-9 © Сидельникова В.М., 2005 © Издательство «Триада-Х», 2005 © Оформление — «Издательский дом «Паллар», 2005
ГиперандрогенияСреди гормональных нарушений, приводящих к невынашиванию беременности, очень большое место занимает гиперандрогения — патологическое состояние, обусловленное изменением секреции и метаболизма андрогенов. По данным многочисленных исследований, 46—77% нарушений менструального цикла, 60—74% эндокринного бесплодия и 21—32% невынашивания беременности в той или иной степени обусловлены гиперандрогенией. Одним из тяжелых последствий гиперандрогении является эндокринное бесплодие. Для невынашивания беременности характерны стертые «неклассические», «позднего начала» формы гиперандрогении, которые представляют наибольшую сложность в выявлении источника избыточного уровня андрогенов, оценке патогенеза, диагностики и тактики ведения. Гиперандрогения надпочечникового генеза — ее «стертые» формы являются, по нашим данным, ведущим фактором невынашивания у 30% женщин с гиперандрогенией. Кора надпочечников состоит из трех зон; клубочковой зоны, вырабатывающей альдостерон; пучковой зоны, вырабатывающей кортизол; сетчатой зоны, вырабатывающей в большей степени андрогены и в меньшей степени кортизол. В процессе метаболизма дефект ферментных систем вызывает целый ряд нарушений на путях биосинтеза гормонов, что ведет к накоплению предшественников выше места дефекта ферментной системы. Передаваясь по наследству как аутосомно-рециссивный признак, такие дефекты затрагивают различные ферменты и вызывают их дефицит различной степени тяжести, что обусловливает разную тяжесть клинических проявлений (Yen S., Saffe, 1998). В норме синтез гормонов в надпочечниках осуществляется следующим образом (схема 1): Холестерол Прегненолон-------------- ►> 17а-ОН-прегненолон ---------------- ► ДЭА-------------- у ДЭА-С Прогестерон-------------- ► 17а-ОН-прогестерон------- ► Андростендион Дезоксикортизол 11 Дезоксикортизол Кортикостерон Кортизол Альдостерон Схема 1. Синтез гормонов в надпочечниках в норме. Таким образом, основными андрогенами, продуцируемыми надпочечниками являются ДЭА, ДЭА-С и андростендион. Они являются слабыми андрогенами, но в тканях организма, особенно в жировой, они конвертируются в андрогены более активные — тестостерон и дигидротестостерон и др. Если для синтеза кортизола и минералокортикоидов роль АКТГ четко доказана, то для синтеза андрогенов необходимы еще какие-то стимулирующие факторы помимо АКТГ. Введение дексаметазона, полностью подавляющее продукцию кортизола, не способно снизить уровень андрогенов ниже 20%, но тем не менее секреция андрогенов подавляется дексаметазоном быстрее чем кортизол, и быстрее восстанавливается, несмотря на то, что нет полного снижения их уровня. Было выявлено, что пролактин принимает участие в синтезе андрогенов, но не кортизола и андростендиона (Parker L и соавт.,1980; FeherT. и соавт.,1985). Инсулино-подобный фактор роста, по-видимому, стимулирует их уровень в плазме (Winterer J. и соавт.,1985). Циркулирующие стероидные гормоны находятся в плазме в связанном с протеинами состоянии — кортикостерон-связыва-ющим глобулином (CBG или транскортином), тестостерон-связывающим глобулином (TeBg) и альбумином. В свободном виде гормоны находятся в незначительном количестве. Неклассические, стертые формы АГС начинают проявляться в зрелом возрасте и напоминают синдром поликистозных яичников, но эти состояния необходимо дифференцировать, так кактактика ведения различна. При недостаточности фермента 21-гидроксилазы (дефицит СУР21А2) нарушения синтеза осуществляются следующим образом (схема 2): Холестерол Прегненолон------------------------ ► 17а-ОН-прегненолон--------------------------------- ► Андрогены I (ДЭА.ДЭА-С, ^ андростендион) Прогестерон 17а-ОН-прогестерон Альдостерон Кортизол Схема 2. Синтез гормонов в надпочечниках при дефиците 21 -гидроксилазы.Диагноз, помимо видимых проявлений маскулинизации, устанавливается на основании повышенного уровня 17ос-гидроксипрогестерона. В дальнейшем андрогены метабол изируются в других тканях. Частично ДЭА быстро превращается в ДЭА-С; андростендион в тестостерон и в эстрон. Андрогены выделяются с мочой в виде метаболитов, объединяемых в группу 17-кетостероидов. По уровню этих метаболитов можно судить об уровне гипер-андрогении, но не об их источнике. На надпочечниковый источник андрогенов указывает высокий уровень 17а-гидроксипрогестерона и дегидроэпиандростерона-сульфата в крови. При диагностике этого нарушения, протекающего в стертой форме, возникает необходимость в функциональных тестах. Если уровень 17а-гидроксипрогестерона выше 500 ng/dl — дальнейшего тестирования не производят, диагноз ясен. При уровне 17 ОНП более 200 ng/dl, но ниже 500 ng/dl проводится проба с АКТГ (0,25млАКТГ(синактен-депо) в/в, через час —контроль). Если уровень 17а-гидроксипрогестерона увеличивается более 1000 ng/dl, а по нашим данным на 236—392%, то диагноз неклассической формы АГС может быть определен. АГС является аутосомно-рецессивным заболеванием и передается по наследству через гены 21-гидроксилазы, расположенные на коротком плече 6 хромосомы в зоне HLA (основного комплекса гистосовместимости). В настоящее время ген 21 гидроксилазы обозначают термином СУР21 и его гомоген — псевдоген СУР21Р (Speiser P.W. и соавт., 1988). Тесная связь между генами 21-гидроксилазы и системой HLA (В14.В35) позволяет выявить возможных носителей активных генов этой патологии в семьях риска (Speiser P.W. и соавт., 1985). Предполагают, что локусаллельных вариантов недостаточности 21 -гидроксилазы определяет разную степень дефицита, что и приводит к фенотипически различным формам (классической, скрытой или стертой) этого заболевания (New M. и соавт., 1983).
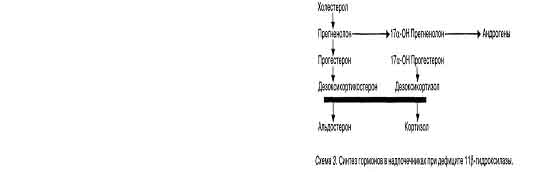
При нарушении 11 р-гидроксилазы — энзима, ответственного за превращения 11 -деоксикортизола в кортизол и деоксикортикостерона в кортикостерон — снижается продукция кортизола и компенсаторно увеличивается уровень АКТГ и увеличивается продукция деоксикортизола и деоксикортикостерона, ДЭА и андростендиона. Заболевание может проявляться в детородном возрасте при стертых его проявлениях и характеризуется гирсутизмом, менструальными нарушениями. При классической форме заболевание характеризуется очень ранним началом, иногда с момента рождения (сольтеряющая форма АГС), выраженной вирилизацией, гипертензией и часто сопровождается миопатией, ретинопатией (AzzizR. исоавт., 1991). Ген 11-гидроксилазы расположен на длинном плече 8 хромосомы, и связи с системой HLA не выявлено (схема 3). У всех больных повышено содержание андрогенов и дезоксикортизола в плазме, особенно после стимуляции в пробе с АКТГ. Дефицит ЗР-гидроксистероиддегидрогеназы наблюдается довольно редко, но этот энзим принимает участие в метаболизме и надпочечников, и яичников и ответственен за синтез прогестерона из прегненолона. В случае недостаточности этого фермента нарушается продукция кортизола, а избыток прегненолона превращается в дегидроэпиандростерон. При частичном дефекте этой системы у взрослых женщин может быть незначительный гирсутизм (ДЭА и ДЭА-С слабые андрогены), но имеются нарушения менструального цикла, напоминающие нарушения при синдроме поликистозных яичников (схема 4). Схема 4. Синтез гормонов в надпочечниках при дефиците зр-гидроксистероиддегидрогеназы. Поданным Botelle-Zlucia(1973), эта форма адреногенитального синдрома наблюдается в основном при опухоли надпочечника. Чаще опухоль поражает один надпочечник, поэтому продукция кортизола и АКТГ поддерживается в состоянии баланса. В случае развития гиперплазии сетчатой зоны коры надпочечников или образования в ней опухоли, которая ведет к атрофии других слоев надпочечника, АГС может сочетаться с болезнью Аддисона — первичной недостаточностью коры надпочечников. При гиперплазии сетчатой и пучковой зон развивается АГС и синдром Кушинга. Однако такие тяжелые заболевания для невынашивания беременности не характерны. Механизм прерывания беременности при стертых формах АГС обусловлен нарушением процессов метаболизма гормонов, наличием ановуляции и неполноценной второй фазы менструального цикла, которая служит клиническим проявлением стертой формы АГС. При классической форме заболевания наблюдается аменорея и бесплодие. По нашим данным, у пациенток с привычным невынашиванием с надпо-чечниковой формой гиперандрогении отмечались повышенные уровни 17-ОП, 17КС и ДЭА, что свидетельствовало о нарушении стероидогенеза по типу поздно возникающего адреногенитального синдрома с дефицитом 21-гидроксилазы. После пробы с дексаметазоном выявлено значительное снижение (соответственно на 80,9%, 92%, 75,8% и 90%) уровней 17КС, ДЭА, 17-ОП и кортизола. Неадекватное увеличение (на 236—392%) концентрации кортизола, ДЭА, 17-ОП после теста с АКТГ у женщин с невыраженными признаками гиперандрогенизма и незначительно измененным базальным уровнем гормонов выявило скрытые формы гиперандрогении надпочечникового генеза. У 90,5% пациенток этой группы был регулярный двухфазный менструальный цикл, невыраженный гирсутизм (гирсутное число 9,4±0,6), т.е. клинические проявления гиперандрогенизма были выражены слабо. У 76,2% пациенток в анамнезе было привычное невынашивание, и у 23,8% — вторичное бесплодие. Гиперандрогения яичникового генеза — синдром поликистозных яичников (СПКЯ) выявлен только у 12,1% обратившихся в отделение невынашивания беременности в связи с прерыванием беременности в анамнезе после успешного лечения бесплодия. В связи с осложненным течением беременности у этой категории больных мы решили остановиться и на этой форме гиперандрогении, хотя характерной особенностью ее является — бесплодие, нерегулярные менструации вплоть до аменореи, гирсутизм. Основным источником гиперпродукции андрогенов у этой группы больных являются яичники. Дисрегуляция цитохром р450Ы7-андроген-образующе-го фермента в яичниках и надпочечниках, по-видимому, является центральным патогенетическим механизмом развития СПКЯ (Rosenfeld R. и соавт., 1990). Причины формирования синдрома ПКЯ остаются неясными. Полагают, что это заболевание начинается с адренархе. В период адренархе происходит стимуляция сетчатой зоны коры надпочечников (сравнимой с тем, что происходит при стрессе), что приводит к увеличению секреции надпочечниками андрогенов и, как следствие этого, усиление образования эстрогенов на периферии (жировая ткань, кожа). Повышенный уровень эстрогенов нарушает соотношение Л Г/ФСГ, что стимулирует яичники к выработке андрогенов. Андрогенная основа этого синдрома смещается с надпочечников на яичники (Chom G., 1973).
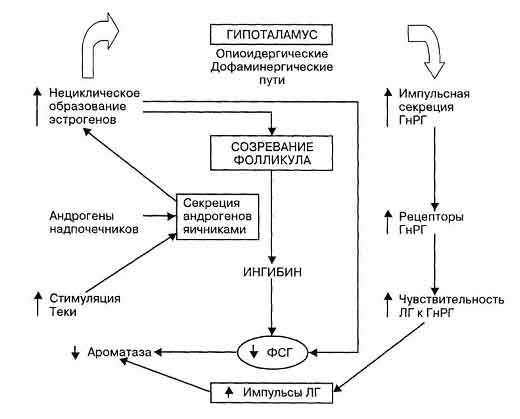
Рис. 10. Патофизиологические механизмы формирования синдрома поликистозных яичников (Yen и Jaffe,1998). Нарушение секреции андрогенов корой надпочечников наблюдается у 50% больных с синдромом по-ликистозных яичников, и эта сочетанная форма гиперандрогении наблюдается наиболее часто в нашей клинике при обследовании женщин с невынашиванием и гиперандрогенией. Имеются данные о наследовании синдрома ПКЯ, как патологии сцепленной с Х-хромосомой (Givens J. и соавт., 1975). Патофизиологические механизмы формирования СПКЯ представлены на рис. 10. и системы гипоталамус-гипофиз-яичники. В результате ароматизации в периферических тканях избыточной продукции андрогенов повышается уровень эстрогенов, в основном, эстро-на, нарушается соотношение Е/Е2. По механизму обратной связи тормозится уровень ФСГ и, соответственно, увеличивается уровень Л Г, что ведет к дополнительной стимуляции андрогенов. В присутствии высокого уровня андрогенов начинается очень рано атрезия фолликулов. Атрезия фолликулов ведет к снижению ФСГ и увеличению ЛГ. При этом наблюдается усиление импульсной секреции ГнРГ, обусловленное снижением продукции прогестерона и диссоциацией опиоид-дофаминергических ингибиторных влияний. Не подвергающийся циклическим изменениям повышенный уровень эстрогенов обусловливает самоподдерживающееся состояние хронической ановуляции. Примерно у половины больных с гиперандрогенией яичникового генеза имеется ожирение. У этих больных часто отмечается гиперинсулинемия и инсу-лино-резистентность, но это скорее обусловлено ожирением, а не гиперандрогенией (Seibel M., 1984). Инсулин изменяет стероидогенез вне зависимости от секреции гонадотропинов при СПКЯ. Инсулин и инсулин-подобный фактор роста I присутствует в овариальных стромальных клетках, и специфический дефект (снижение аутофосфориляции) при связывании инсулиновых рецепторов наблюдается у 50% больных с СПКЯ. В связи с этим, у больных с СПКЯ нередко наблюдается развитие диабета, и при беременности необходим контроль толерантности к глюкозе. Нормализация углеводного обмена может быть при снижении массы тела, при этом снижается и уровень андрогенов. Диагностика СПКЯ основывается на данных клинического, гормонального обследования и данных УЗИ. По нашим данным, у больных с СПКЯ более выражены проявления андрогенизации: гирсутное число 15,2±0,6; повышен индекс мас-сытела(26,3±0,8). У всех пациенток отмечалась олигоменорея, ановуляция, значительное снижение генеративной функции (в анамнезе первичное бесплодие, а после прервавшейся беременности у 64,7% — вторичное бесплодие). Гормональное обследование выявило у всех пациенток высокую концентрацию ЛГ, Т, увеличение уровня ФСГ. При УЗИ отмечено у 78,6% увеличение яичников с характерной картиной — увеличение объема яичников, гиперплазией стромы, более Юатретичных фолликулов, размером от 5 до 10 мм, расположенных по периферии под утолщенной капсулой. Смешанная форма гиперандрогении — эта группа больных наиболее неоднородна по содержанию гормонов (равно как и по клиническим параметрам). Среди контингента женщин с гиперандрогенией эта группа была наиболее многочисленной и составила 57,9%. Характерным для этой группы является достоверное увеличение уровня ДЭА (р< 0,001) и умеренная гиперпролактинемия (р< 0,001). По сравнению с гормональными показателями у женщин с надпочечниковой гиперандрогенией у пациенток со смешанной формой отсутствовало достоверное повышение 17-ОП и уровень экскреции 17КС был повышен только у 51,3% женщин. Отличительной особенностью по содержанию гормонов от пациенток с яичниковой гиперандрогенией было умеренное увеличение ЛГ при нормальных величинах ФСГ, у 1/3 больных содержание ФСГ было сниженным. Клиническая картина у больных со смешанной формой гиперандрогении включала симптомы, характерные для пациенток с надпочечниковой и яичниковой гиперандрогенией. У 49,9% женщин менструальный цикл был нарушен (олигоменорея, аменорея), отмечалась ановуляция и бесплодие. По данным УЗИ у 46,1% пациенток этой группы были увеличены яичники и у 69,2% — мелкокис-тозные изменения характерные для СПКЯ. Гирсутное число (18,3 ±1,0) и ИМТ (26,5±0,7) у больных с повышенным уровнем 17-КС были достоверно выше таковых у женщин этой группы с нормальным уровнем 17-КС. У большинства больных (96%) имелись изменения ЭЭГ, у 60,6% выявлены изменения на краниограммах. У каждой второй пациентки в жизни отмечены стрессовые ситуации, травмы, высокий инфекционный индекс. Применение пробы с дексаметазоном и хорионическим гонадотропином | позволило выявить смешанный источник избыточного содержания андрогенов: ; тенденция к росту уровня 17-КС, достоверное увеличение содержания тестостерона и 17 оксипрогестерона после стимуляции ХГ на фоне приема дексаметазона. Данные медико-генетического исследования, проведенные у женщин с гиперандрогенией, показали, что у 14,3% женщин с надпочечниковой и смешанной формами гиперандрогении были выявлены семейные формы нарушений репродуктивной функции и гирсутизма. У родственников пациенток с этими формами гиперандрогении по сравнению с популяционными данными выявлено учащение бесплодия в 4 раза, невынашивания беременности — в 10 раз, нарушения менструального цикла — в 11 раз и гирсутизма — в 14 раз. У пациенток с яичниковой формой гиперандрогении генетическая природа заболевания была менее выражена. Вместе с тем у 50% больных родословная была отягощена гирсутиз-мом, нарушениями менструального цикла, самопроизвольными выкидышами и врожденными пороками развития. Комплекс проведенных клинико-гормональных исследований у пациенток с различными формами гиперандрогении, страдающих невынашиванием беременности, показал, что эти формы, по-существу, являются проявлением клинического полиморфизма единой патологии, зависящей от длительности и глубины патологического процесса и имеющей в своей основе единую первопричину -нарушение гипоталамо-гипофизарно-надпочечниково-яичниковых взаимоотношений на различных этапах развития женского организма. Значительная роль в генезе этих нарушений принадлежит средовым факторам (различные заболевания, инфекции, травмы, психо-эмоциональный стресс и др.), которые являются триггером в реализации патологического процесса у больных с отягощенным генетическим фоном. Согласно полученным данным, больные с надпочечниковой гиперандрогенией могут быть отнесены к начальной стадии заболевания. Об этом свидетельствуют особенности клинико- гормонального статуса с незначительно выраженными симптомами андрогенизации, высокая частота реабилитированных больных. По мере углубления нарушений в системе гипоталамус-гипофиз-надпочечники в патологический процесс вовлекаются яичники с возникновением в них структурных и функциональных нарушений, что приводит к образованию более тяжелых смешанных форм патологии, представляющих значительные сложности в диагностике и лечении, и чрезвычайно большие сложности в ведении беременности у этого контингента больных. Тактика подготовки к беременности пациенток с гиперандрогенией1. Надпочечниковая гиперандрогенияПо тестам функциональной диагностики: — НЛФ в чередовании с ановуляцией; — Инфекция, как причина невынашивания и НЛФ, исключена; — Нет внутриматочныхсинехий; — Особенности кариотипа могут быть или не быть; — Совместимости по HLA нет; — Нет аутоиммунных нарушений; — По данным УЗИ яичники не изменены; — Есть андроидный тип строения тела, широкие плечи, узкие бедра есть! гирсутизм; — Гормональные параметры выявляют повышение уровня 17КС (иногда! только во II фазу цикла), ДЭА-С, 17ОП повышены или эти показатели наверхней границе нормы; — В анамнезе — неразвивающиеся беременности. При такой ситуации необходимо уточнить источник гиперандрогении. Провести пробу с дексаметазоном — снижение уровней 17-КС, 17-ОП и ДЭА-С на 80—90% означает, что источник андрогенов — надпочечники. При неясных клинических данных, при подозрении на гиперандрогению, необходимо провести пробу с АКТГ (синактен-депо). Неадекватное увеличение содержания кортизола, ДЭА и 17-ОП указывает на скрытую, неклассическую форму адреногенитального синдрома. При установлении диагноза надпочечниковой гиперандрогении подготовка к беременности заключается в назначении дексаметазона в дозе от 0,125 мг до 0,5 мг под контролем 17-КС в моче или 17-ОП и ДЭА-С в крови. У большинства пациенток после начала приема дексаметазона нормализуется менструальный цикл, наблюдается нормальная овуляция и беременность (нередко на фоне декса-метазоновой пробы). Одновременно с дексаметазоном назначаются комплексы метаболической терапии или витамины для беременных с дополнительной таблеткой фолиевой кислоты. При отсутствии беременности в течение 2—3 циклов можно провести стимуляцию овуляции клостилбегидом или кломифеном в дозе 50 мг с 5 по 9 день цикла на фоне приема дексаметазона. Альтернативным методом подготовки к беременности может быть дача контрацептива с антиандрогенным эффектом — Диана -35 на два-три цикла. И в цикле, когда планируется беременность, — дексаметазон с 1 -го дня цикла. По нашим данным, у 55% больных с надпочечниковой гиперандрогенией беременность наступила только на фоне лечения дексаметазоном. Длительность реабилитационной терапии составила в среднем 2,4 циклов. При беременности все пациентки с надпочечниковой гиперандрогенией должны продолжать прием дексаметазона в индивидуально подобранной дозе, которая, как правило, не превышает 0,5 мг (чаще 1/2 или 1/4 таблетки). Подготовка к беременности пациенток с яичниковой формой гиперандрогении— В анамнезе: позднее менархе, нарушение менструального цикла по типу олигоменореи первичной, либо вторичной, нередко — вторичная аменорея. Беременности наступают редко и прерываются по типу неразвивающейся беременности, между беременностями длительные периоды бесплодия; — По тестам функциональной диагностики в основном ановуляция и очень редко овуляторные циклы с НЛФ; — Отмечается гирсутизм, акне, стрии, особенности пигментации тембр голоса, особенности морфометрии, высокий индекс массы тела; — При гормональном исследовании отмечается повышенный уровень тестостерона, нередко повышенный уровень ЛГ и ФСГ, соотношение ЛГ/ФСГ больше 3; уровень 17-КС повышен; — При УЗИ выявляются поликистозные яичники; — Инфекция исключена, либо вылечена. Учитывая, что у 2/3 больных с гиперандрогенией в процессе беременности наблюдается истмико-цервикальная недостаточность Тактика ведения беременности при надпочечниковой гиперандрогении Лечение проводится в течение всей беременности, учитывая врожденный дефект патологии. Если прекратить прием дексаметазона, беременность может не прерваться за счет того, что плод возьмет на себя снабжение глюкокортикои-дами. В связи с этим может быть внутриутробно гиперфункция коры надпочечников, а в момент стресса (родовой процесс) ребенок может погибнуть. При па-тологоанатомическом исследовании находят атрофию коры надпочечников. Поэтому, если под влиянием терапии дексаметазоном уровень 17-КС снижается больше, чем нам бы хотелось, доза дексаметазона может быть уменьшена до 1/ 4 таблетки через день, но прекращать прием нецелесообразно. Особое внимание следует уделять срокам беременности 13, 24 и 28 недель. Эти сроки связаны с вступлением плодовых эндокринных органов в активную продукцию, что может провоцировать повышенную продукцию андрогенов. На 3—4 день после родов постепенно снижают дозу дексаметазона и прекращают терапию на 7—8 день после родов. При АГС с нормальным уровнем 17-КС или 17-ОП, но с повышенным уровнем ДЭАС, терапию дексаметазоном можно проводить только до 16 недель беременности (считая с овуляции). К этому моменту плацента завершает свое развитие, и уже стероидогенез обеспечивает достаточно эстрогенов, так что доля надпочечников в их продукции не столь существенна. Назначение препаратов прогестероновго ряда при гиперандрогении над-почечникового генеза нецелесообразно, так как у них, как правило, наблюдается гиперпрогестеронемия. Необходим контроль состояния шейки матки, так как возможна истмико-цервикальная недостаточность, которая наблюдается у 2/3 беременных с АГС, в том числе при ее стертых проявлениях. В процессе беременности проводится контроль состояния плода и профилактика плацентарной недостаточности с I триместра. При разработке тактики ведения родов следует обратить внимание на особенности строения таза, так как у пациенток с гипер-андрогенией строение таза с сужением выхода, что может осложнить течение родов. При крайне отягощенном анамнезе, тазовом предлежании и анатомических особенностях таза целесообразно родоразрешение путем операции кесарева сечения. При рождении ребенка необходимо сообщить неонаталогу о дозах и длительности приема дексаметазона, так как у ребенка может быть синдром отмены глюкокортикоидов. Учитывая, что пациентки с АГС могут передать ген АГС плоду, необходима пренатальная диагностика, которую мы проводим одновременно с диагностикой у плода болезни Дауна. В 17—18 недель проводится исследование крови матери для определения уровней ocFP, ХГ, Е2, и 17ОП. При повышенном уровне 17-ОП необходимо сделать амниоцентез и определить уровень 17-ОП в амниоти-ческой жидкости. При высоком уровне 17-ОП диагностируется АГС у плода. К сожалению, по современным тестам можно поставить диагноз, но очень трудно определить степень тяжести АГС, которая может быть от неклассической легкой формы заболевания |
| Copyright MyCorp © 2024 |
| Конструктор сайтов - uCoz |